2024
Article dans une revue
Exopolysaccharide from marine microalgae belonging to the Glossomastix genus: fragile gel behavior and suspension stability
Virginie Dulong
,
Christophe Rihouey
,
Clément Gaignard
,
Nicolas Bridiau
,
Priscilla Gourvil
,
Céline Laroche
,
Guillaume Pierre
,
Tony Varacavoudin
,
Ian Probert
,
Thierry Maugard
,
Philippe Michaud
,
Luc Picton
,
Didier Le Cerf
2023
Article dans une revue
Role of some structural features in EPS from microalgae stimulating collagen production by human dermal fibroblasts
Claire Toucheteau
,
Valentine Deffains
,
Clément Gaignard
,
Christophe Rihouey
,
Céline Laroche
,
Guillaume Pierre
,
Olivier Lépine
,
Ian Probert
,
Didier Le Cerf
,
Philippe Michaud
,
Ingrid Arnaudin-Fruitier
,
Nicolas Bridiau
,
Thierry Maugard
A Screening Approach to Assess the Impact of Various Commercial Sources of Crude Marine λ-Carrageenan on the Production of Oligosaccharides with Anti-heparanase and Anti-migratory Activities
Chanez Manseur
,
Hugo Groult
,
Manon Porta
,
Pierre-Edouard Bodet
,
Rachida Mersni-Achour
,
Raphaëlle Petit
,
Samir Ali-Moussa
,
Benjamin Musnier
,
Didier Le Cerf
,
Tony Varacavoudin
,
Oualid Haddad
,
Angela Sutton
,
Cíntia Emi Yanaguibashi Leal
,
Edilson Beserra Alencar-Filho
,
Jean-Marie Piot
,
Nicolas Bridiau
,
Thierry Maugard
,
Ingrid Fruitier-Arnaudin
2022
Brevet
NOVEL DEPOLYMERIZED EXOPOLYSACCHARIDES, DERIVED FROM MICROALGAE, METHOD FOR PREPARING SAME, AND USES THEREOF IN COSMETICS FOR DELAYING THE EFFECTS OF SKIN AGEING
Thierry Maugard
,
Nicolas Bridiau
,
Ingrid Arnaudin
France, Patent n° : WO2022/184746 A1. 2022
USE OF MICROALGAL EXOPOLYSACCHARIDES AS TEXTURIZING AGENTS
Thierry Maugard
,
Nicolas Bridiau
,
Ingrid Arnaudin
France, Patent n° : WO2022/184745 A1. 2022
2021
Brevet
Utilisation d'exopolysaccharides de micro-algues à titre d'agents texturants
Olivier Gonçalves
,
Jeremy Pruvost
,
Anthony Massé
,
Antoine Decamp
,
Ian Probert
,
Clément Gaignard
,
Céline Laroche
,
Guillaume Pierre
,
Cédric Delattre
,
Pascal Dubessay
,
Philippe Michaud
,
Didier Le Cerf
,
Luc Picton
,
Virginie Dulong
,
Christophe Rihouey
,
Thierry Maugard
,
Ingrid Arnaudin
,
Nicolas Bridiau
,
Claire Toucheteau
France, N° de brevet: FR2102024. 2021
Nouveaux exopolysaccharides dépolymérisés, issus de micro-algues, leur procédé de préparation et leurs utilisations en cosmétique pour retarder les effets du vieillissement cutané
Olivier Goncalves
,
Jeremy Pruvost
,
Anthony Massé
,
Antoine Decamp
,
Ian Probert
,
Thierry Maugard
,
Ingrid Arnaudin
,
Nicolas Bridiau
,
Claire Toucheteau
,
Didier Le Cerf
,
Luc Picton
,
Virginie Dulong
,
Christophe Rihouey
,
Clément Gaignard
,
Céline Laroche
,
Guillaume Pierre
,
Cédric Delattre
,
Pascal Dubessay
,
Philippe Michaud
France, N° de brevet: FR2102020. 2021
Communication dans un congrès
Production of collagen and hyaluronic acid by human dermal fibroblasts stimulated by EPS from microalgae: some structural and mechanistic aspects
Claire Toucheteau
,
Valentine Deffains
,
Ian Probert
,
Guillaume Pierre
,
Céline Laroche
,
Christophe Rihouey
,
Luc Picton
,
Didier Le Cerf
,
Ingrid Arnaudin
,
Philippe Michaud
,
Nicolas Bridiau
,
Thierry Maugard
7th International Congress of the European Polysaccharide Network of Excellence, Oct 2021, Nantes, France
2020
Article dans une revue
Ulva intestinalis Protein Extracts Promote In Vitro Collagen and Hyaluronic Acid Production by Human Dermal Fibroblasts
Justine Bodin
,
Amandine Adrien
,
Pierre-Edouard Bodet
,
Delphine Dufour
,
Stanislas Baudouin
,
Thierry Maugard
,
Nicolas Bridiau
Chapitre d'ouvrage
Bioactive polysaccharides from microalgae
Nastasia Prybylski
,
Claire Toucheteau
,
Hicham El Alaoui
,
Nicolas Bridiau
,
Thierry Maugard
,
Slim Abdelkafi
,
Imen Fendri
,
Cédric Delattre
,
Pascal Dubessay
,
Guillaume Pierre
,
Philippe Michaud
Brevet
Extraits protéiques de macroalgues marine, compositions en contenant et utilisation cosmétique anti-âge
Justine Bodin
,
Amandine Adrien
,
Delphine Dufour
,
Stanislas Baudouin
,
Nicolas Bridiau
,
Thierry Maugard
France, N° de brevet: FR3084836 (A1). 2020
2019
Article dans une revue
Anticoagulant Activity of Sulfated Ulvan Isolated from the Green Macroalga Ulva rigida
Amandine Adrien
,
Antoine Bonnet
,
Delphine Dufour
,
Stanislas Baudouin
,
Thierry Maugard
,
Nicolas Bridiau
λ-Carrageenan Oligosaccharides of Distinct Anti-Heparanase and Anticoagulant Activities Inhibit MDA-MB-231 Breast Cancer Cell Migration
Hugo Groult
,
Rémi Cousin
,
Caroline Chot-Plassot
,
Maheva Maura
,
Nicolas Bridiau
,
Jean-Marie Piot
,
Thierry Maugard
,
Ingrid Fruitier-Arnaudin
2018
Brevet
Utilisation d’un extrait d’ulve comme agent cosmétique anti-age.
Stanislas Baudouin
,
Delphine Dufour
,
Amandine Adrien
,
Thierry Maugard
,
Nicolas Bridiau
France, N° de brevet: FR3057770 (A1), 27/04/2018, n° 16/70618. 2018
Polysaccharide sulfaté extrait d’une algue rouge pour son utilisation en tant qu’anticoagulant
Cédric Delattre
,
Philippe Michaud
,
Guillaume Pierre
,
Nicolas Bridiau
,
Thierry Maugard
,
Taratra Andrée Fenoradosoa
,
Hernas Martial Rakotoarisoa
France, N° de brevet: FR3055549 (A1). 2018
Nouvel actif immunomodulateur et composition le comprenant
Cédric Delattre
,
Phillipe Michaud
,
Guillaume Pierre
,
Nicolas Bridiau
,
Thierry Maugard
,
Taratra André Fenoradosoa
,
Hernas Martial Rakotoarisoa
France, N° de brevet: FR3055550 (A1). 2018
2017
Article dans une revue
Family of Bioactive Heparin-Coated Iron Oxide Nanoparticles with Positive Contrast in Magnetic Resonance Imaging for Specific Biomedical Applications
Hugo Groult
,
Nicolas Poupard
,
Fernando Herranz
,
Egle Conforto
,
Nicolas Bridiau
,
Frédéric Sannier
,
Stéphanie Bordenave
,
Jean-Marie Piot
,
Jesus Ruiz-Cabello
,
Ingrid Fruitier-Arnaudin
,
Thierry Maugard
Semi-pilot scale-up of a continuous packed-bed bioreactor system developed for the lipase-catalyzed production of pseudo-ceramides
Florian Le Joubioux
,
Nicolas Bridiau
,
Marianne Graber
,
Thierry Maugard
Production of heparin and λ-carrageenan anti-heparanase derivatives using a combination of physicochemical depolymerization and glycol splitting
Nicolas Poupard
,
Hugo Groult
,
Justine Bodin
,
Nicolas Bridiau
,
Stéphanie Bordenave-Juchereau
,
Frédéric Sannier
,
Jean-Marie Piot
,
Ingrid Fruitier-Arnaudin
,
Thierry Maugard
Identification of ace inhibitory cryptides in Tilapia protein hydrolysate by UPLC–MS/MS coupled to database analysis
Yesmine Ben Henda
,
Antoine Bonnet
,
Ortência Leocádia Nunes Gonzalez da Silva
,
Rogério Boscolo Wilson
,
Ingrid Arnaudin
,
Nicolas Bridiau
,
Thierry Maugard
,
Jean-Marie Piot
,
Frédéric Sannier
,
Stéphanie Bordenave-Juchereau
Assessment of Heparanase-Mediated Angiogenesis Using Microvascular Endothelial Cells: Identification of λ-Carrageenan Derivative as a Potent Anti Angiogenic Agent
Nicolas Poupard
,
Pamela Badarou
,
Fabienne Fasani
,
Hugo Groult
,
Nicolas Bridiau
,
Frédéric Sannier
,
Stéphanie Bordenave-Juchereau
,
Claudine Kieda
,
Jean-Marie Piot
,
Catherine Grillon
,
Ingrid Fruitier-Arnaudin
,
Thierry Maugard
Pilot production of ulvans from Ulva sp. and their effects on hyaluronan and collagen production in cultured dermal fibroblasts
Amandine Adrien
,
Antoine Bonnet
,
Delphine Dufour
,
Stanislas Baudouin
,
Thierry Maugard
,
Nicolas Bridiau
Communication dans un congrès
Production d’ulvanes de différents poids moléculaires provenant de l'algue Ulva sp., et leurs effets sur la production d'hyaluronane et de collagène par des fibroblastes cutanés humains
Amandine Adrien
,
Nicolas Bridiau
,
Delphine Dufour
,
Stanislas Baudouin
,
Thierry Maugard
2ème Colloque du GDR Cosm’actifs (GDR 3711) « Vers une Cosmétique Durable », Sep 2017, Nouan-Le-Fuzelier, France
2016
Article dans une revue
Alteration of cathepsin D trafficking induced by hypoxia and extracellular acidification in MCF-7 breast cancer cells
Oussama Achour
,
Yahya Ashraf
,
Nicolas Bridiau
,
Meriem Kacem
,
Nicolas Poupard
,
Stéphanie Bordenave-Juchereau
,
Frédéric Sannier
,
Nathalie Lamerant-Fayel
,
Claudine Kieda
,
Emmanuelle Liaudet-Coopman
,
Jean-Marie Piot
,
Thierry Maugard
,
Ingrid Fruitier-Arnaudin
Anti-heparanase activity of ultra-low-molecular-weight heparin produced by physicochemical depolymerization
Oussama Achour
,
Nicolas Poupard
,
Nicolas Bridiau
,
Stéphanie Bordenave-Juchereau
,
Frédéric Sannier
,
Jean-Marie Piot
,
Ingrid Fruitier-Arnaudin
,
Thierry Maugard
Brevet
Utilisation d’un extrait d’ulve comme agent cosmétique anti-age.
Stanislas Baudouin
,
Delphine Dufour
,
Amandine Adrien
,
Thierry Maugard
,
Nicolas Bridiau
France, N° de brevet: FR3057770 (A1), 27/04/2018, n° 16/70618. 2016
Polysaccharides sulfatés provenant de macro-algues vertes type Ulva sp. et leurs utilisations pour la régulation des troubles de la coagulation
Adrien Amandine
,
Nicolas Bridiau
,
Stanislas Baudouin
,
Dufour Delphine
,
Thierry Maugard
France, N° de brevet: 16/50735. 2016
Communication dans un congrès
Polysaccharides marins pour des applications en santé humaine
Nicolas Bridiau
Journées scientifiques de l'Université de Nantes - Exopolysaccharides marins et biotechnologies bleues, Jun 2016, Nantes, France
Evaluation of the anticoagulant potential of polysaccharide-rich fractions extracted from macroalgae
Amandine Adrien
,
Antoine Bonnet
,
Joaquim Yao
,
Nicolas Bridiau
,
Delphine Dufour
,
Stanislas Baudouin
,
Thierry Maugard
6th International Congress of Aromatic and Medicinal Plants (CIPAM 2016), May 2016, Coimbra, Portugal
2015
Article dans une revue
Characterization of the colistin (polymyxin E1 and E2) biosynthetic gene cluster.
Fatoumata Tambadou
,
Thibault Caradec
,
Anne-Laure Gagez
,
Antoine Bonnet
,
Valérie Sopena
,
Nicolas Bridiau
,
Valérie Thiéry
,
Sandrine Didelot,
,
Cyrille Barthélémy
,
Romain Chevrot
Di and tripeptides from marine sources can target adipogenic process and contribute to decrease adipocyte number and functions
Yesmine Ben Henda
,
Mariem Laamari
,
Isabelle Lanneluc
,
Marie-Agnès Travers
,
Hélène Agogué
,
Ingrid Arnaudin
,
Nicolas Bridiau
,
Thierry Maugard
,
Jean-Marie Piot
,
Frédéric Sannier
,
Stéphanie Bordenave-Juchereau
Communication dans un congrès
La lipase B de Candida antarctica : un outil performant pour la production continue de pseudo-céramides
Florian Le Joubioux
,
Mehdi Sanekli
,
Yesmine Ben Henda
,
Oussama Achour
,
Nicolas Bridiau
,
Marianne Graber
,
Thierry Maugard
Les lipides du futur : les lipases au coeur des développements scientifiques et industriels, Nov 2015, Romainville, France
Activité anticoagulante d'extraits de macroalgues riches en polysaccharides sulfatés
Amandine Adrien
,
Nicolas Bridiau
,
Delphine Dufour
,
Stanislas Baudouin
,
Thierry Maugard
Journées phycologiques de France, Sep 2015, Vannes, France
2014
Article dans une revue
Dextranase immobilization on epoxy CIM® disk for the production of isomaltooligosaccharides from dextran
Emmanuel Bertrand
,
Guillaume Pierre
,
Cédric Delattre
,
Christine Gardarin
,
Nicolas Bridiau
,
Thierry Maugard
,
Philippe Michaud
Continuous lipase-catalyzed production of pseudo-ceramides in a packed-bed bioreactor
Florian Le Joubioux
,
Nicolas Bridiau
,
Mehdi Sanekli
,
Marianne Graber
,
Thierry Maugard
Communication dans un congrès
Epoxy CIM® Disk comme nouveaux supports d’immobilisation de dextranases pour la production continue d’isomaltooligosaccharides
Guillaume Pierre
,
Emmanuel Bertrand
,
Cédric Delattre
,
Christine Gardarin
,
Seltanna Chalane
,
Nicolas Bridiau
,
Thierry Maugard
,
Aleš Štrancar
,
Philippe Michaud
25eme colloque CBSO, Jun 2014, Carry-le-Rouet, France
Production continue de pseudo-céramides catalysée par la lipase B de Candida antarctica (Novozym® 435) dans un bioréacteur à lit fixe
Florian Le Joubioux
,
Nicolas Bridiau
,
Mehdi Sanekli
,
Marianne Graber
,
Thierry Maugard
25ème colloque du Club de Biocatalyse en Synthèse Organique, Jun 2014, Carry-le-Rouet, France
2013
Article dans une revue
Measuring Angiotensin-I Converting Enzyme Inhibitory Activity by Micro Plate Assays: Comparison Using Marine Cryptides and Tentative Threshold Determinations with Captopril and Losartan
Yesmine Ben Henda
,
Anis Labidi
,
Ingrid Arnaudin
,
Nicolas Bridiau
,
Régis Delatouche
,
Thierry Maugard
,
Jean-Marie Piot
,
Frédéric Sannier
,
Valérie Thiery
,
Stéphanie Bordenave-Juchereau
Journal of Agricultural and Food Chemistry, 2013, 61 (45), pp.10685-10690
Antiproliferative Activity of Cyanophora paradoxa Pigments in Melanoma, Breast and Lung Cancer Cells
Paul-Hubert Baudelet
,
Anne-Laure Gagez
,
Jean-Baptiste Berard
,
Camille Juin
,
Nicolas Bridiau
,
Raymond Kaas
,
Valerie Thiery
,
Jean-Paul Cadoret
,
Laurent Picot
Cathepsin D activity and selectivity in the acidic conditions of a tumor microenvironment: Utilization in the development of a novel Cathepsin D substrate for simultaneous cancer diagnosis and therapy
Oussama Achour
,
Nicolas Bridiau
,
Meriem Kacem
,
Régis Delatouche
,
Stéphanie Bordenave-Juchereau
,
Frédéric Sannier
,
Valérie Thiery
,
Jean-Marie Piot
,
Thierry Maugard
,
Ingrid Arnaudin
Biochimie, 2013, 95 (11), pp.2010-2017
Antiproliferative Activity of Cyanophora paradoxa Pigments in Melanoma, Breast and Lung Cancer Cells
Paul-Hubert Baudelet
,
Anne-Laure Gagez
,
Jean-Baptiste Bérard
,
Camille Juin
,
Nicolas Bridiau
,
Raymond Kaas
,
Valérie Thiéry
,
Jean-Paul Cadoret
,
Laurent Picot
Marine drugs, 2013, 11 (11), pp.4390-4406
Ultrasonic-assisted preparation of a low molecular weight heparin (LMWH) with anticoagulant activity
Oussama Achour
,
Nicolas Bridiau
,
Azza Godhbani
,
Florian Le Joubioux
,
Stephanie Bordenave Juchereau
,
Frédéric Sannier
,
Jean-Marie Piot
,
Ingrid Fruitier Arnaudin
,
Thierry Maugard
Carbohydrate Polymers, 2013, 97 (2), pp.684-689
The control of Novozym® 435 chemoselectivity and specificity by the solvents in acylation reactions of amino-alcohols
Florian Le Joubioux
,
Nicolas Bridiau
,
Yesmine Ben Henda
,
Oussama Achour
,
Marianne Graber
,
Thierry Maugard
2012
Article dans une revue
The effect of substrate structure on the chemoselectivity of Candida antarctica lipase B-catalyzed acylation of amino-alcohols
Florian Le Joubioux
,
Yesmine Ben Henda
,
Nicolas Bridiau
,
Oussama Achour
,
Marianne Graber
,
Thierry Maugard
Journal of Molecular Catalysis B: Enzymatic, 2012, 85-86, pp.193-199
Bacillus circulans β-galactosidase catalyses the synthesis of N-acetyl-lactosamine in a hydro-organic medium via a steady-state ordered Bi Bi reaction mechanism
Nicolas Bridiau
,
Thierry Maugard
Communication dans un congrès
Aide au ciblage du microenvironnement tumoral par le développement d'un nano-système de détection et de traitement de tumeurs visant l'inhibition spécifique de l'héparanase
Azza Ghodhbani
,
Meriem Kacem
,
Oussama Achour
,
Florian Le Joubioux
,
Régis Delatouche
,
Nicolas Bridiau
,
Valérie Thiéry
,
Jean-Marie Piot
,
Thierry Maugard
,
Ingrid Fruitier-Arnaudin
Journées de la Section Régionale Centre-Ouest de la Société Chimique de France, Dec 2012, Poitiers, France
2011
Article dans une revue
Kinetic study of 2-butanol O-acylation and sec-butylamine N-acylation catalyzed by Candida antarctica lipase B
Florian Le Joubioux
,
A. Oussama
,
Nicolas Bridiau
,
Marianne Graber
,
Thierry Maugard
Journal of Molecular Catalysis B: Enzymatic, 2011, 70, pp.108-113
A comparative study of the regioselectivity of the β-galactosidases from Kluyveromyces lactis and Bacillus circulans in the enzymatic synthesis of N-Acetyl-lactosamine in aqueous media
Nicolas Bridiau
,
Thierry Maugard
Kinetic study of 2-butanol O-acylation and sec-butylamine N-acylation catalyzed by Candida antarctica lipase B
Florian Le Joubioux
,
Oussama Achour
,
Nicolas Bridiau
,
Marianne Graber
,
Thierry Maugard
2010
Article dans une revue
The effects of organic solvents on the efficiency and regioselectivity of N-acetyl-lactosamine synthesis, using the β-galactosidase from Bacillus circulans in hydro-organic media
Nicolas Bridiau
,
Neyssène Issaoui
,
Thierry Maugard
Communication dans un congrès
Effets du co-solvant organique sur l’efficacité et la régio-sélectivité de la synthèse de N-acétyl-lactosamine, catalysée par la β-galactosidase de Bacillus circulans en milieu hydro-organique
Nicolas Bridiau
,
Neyssen Issaoui
,
Thierry Maugard
23ème colloque du Club Bioconversion en Synthèse Organique, May 2010, Royat, France
2009
Article dans une revue
Facile synthesis of pseudo-C-glycosyl p-amino-dl-phenylalanine building blocks via Amadori rearrangement
Nicolas Bridiau
,
Sandrine Cabanel
,
Thierry Maugard
2007
Article dans une revue
One-pot stereoselective synthesis of β-N-aryl-glycosides by N-glycosylation of aromatic amines: application to the synthesis of tumor-associated carbohydrate antigen building blocks
Nicolas Bridiau
,
Moulay Benmansour
,
Marie-Dominique Legoy
,
Thierry Maugard
Communication dans un congrès
Chemoenzymatic synthesis of β-D-Galp-(1-4)-β-D-GlcpNAc-N-p-amino-phenylalanine and analogues : application to the synthesis of tumor-associated carbohydrate antigens building blocks
Nicolas Bridiau
,
Marie-Dominique Legoy
,
Thierry Maugard
3ème journée thématique organisée par le Groupe Français des Peptides et Protéines : "Du Glycosynthon à la Glycoprotéine : un défi pour chimistes et biologistes", Sep 2007, Orléans, France
Synthèse stéréosélective directe de β-N-aryl-glycosides par N-glycosylation d’amines aromatiques : application à la synthèse d’antigènes tumoraux
Nicolas Bridiau
,
Moulay Benmansour
,
Marie-Dominique Legoy
,
Thierry Maugard
5ème édition du Symposium de Chimie Organique Centre-Auvergne-Limousin Poitou-Charentes, May 2007, La Rochelle, France
2006
Article dans une revue
β-Galactosidase Catalyzed Selective Galactosylation of Aromatic Compounds
Nicolas Bridiau
,
Selma Taboubi
,
Marie-Dominique Legoy
,
Thierry Maugard
Communication dans un congrès
Synthèse stéréosélective directe de β-N-aryl-glycosides par N-glycosylation d’amines aromatiques : application à la synthèse d’antigènes tumoraux
Nicolas Bridiau
,
Moulay Benmansour
,
Marie-Dominique Legoy
,
Thierry Maugard
Journées de la Section Régionale Centre-Ouest de la Société Française de Chimie, Dec 2006, Poitiers, France

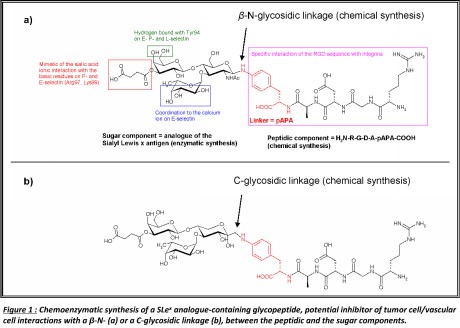 (cliquez sur l’image pour l’agrandir)
(cliquez sur l’image pour l’agrandir)


