Ecophysiologie

Le plateau « écophysiologie » fournit au laboratoire LIENSs des outils et des installations pour l’étude des réponses physiologiques et comportementales des organismes des milieux littoraux, à des variables environnementales (température, oxygène, contaminants…). Ce plateau dispose de plusieurs installations d’élevage modulables, pouvant accueillir divers organismes aquatiques (poissons, échinodermes, mollusques bivalves,….), nécessaires aux activités de recherche de l’équipe AMARE.
Le laboratoire dispose ainsi de six salles thermostatées, permettant de maintenir, d’exposer et de tester des organismes dans des conditions environnementales contrôlées (température, concentrations métalliques, oxygène, dioxyde de carbone, etc.) :
- Deux « salles humides », équipées d’arrivées en eau de mer, oxygène et azote gazeux. Ces salles contiennent actuellement des bassins d’élevage de poissons (mulets, civelles) et de mollusques bivalves (Macoma balthica).
- Une « salle expérimentale » où deux systèmes de régulations de pCO2 (IKS Aquastar®) permettent d’étudier, dans 16 bacs simultanément, de volumes compris entre 500 ml et 50 l, les réponses des organismes dans le contexte de l’acidification des océans.
- Une « salle d’élevage » équipée d’arrivée en eau douce maintenue à 26°C, où 36 aquariums hébergent actuellement un élevage de killifish Nothobranchius furzeri et une « salle expérimentale » où des mesures comportementales et physiologiques sont menées sur cette même espèce.

A l’heure actuelle, le plateau dispose de l’agrément français à l’expérimentation et l’utilisation des animaux à des fins scientifiques.
Le plateau met également à disposition des chercheurs une salle de culture cellulaire.
MESURES RÉALISÉES A L’ÉCHELLE DE L’INDIVIDU
Activités principales
- Étude de la biomécanique, des interactions proies-prédateurs, et du comportement de nage (challenge natatoire, fast-start, réponse de fuite) en environnement variable.
- Étude des performances de nage et de la bio-énergétique en environnement variable.
Équipements principaux
![]() Caméra haute vitesse
Caméra haute vitesse
![]() Tunnels de nage (Figure 1), respiromètres statiques, oxymètres
Tunnels de nage (Figure 1), respiromètres statiques, oxymètres
Responsable Christel Lefrançois – +33 (0)5 46 50 72 17 – clefranc@univ-lr.fr

- Figure 1.Tunnel de nage
MESURES RÉALISÉES A L’ÉCHELLE DE LA CELLULE ET DE L’ORGANE
Activités principales
- Approches expérimentales réalisées à l’échelle de la cellule sur différentes fonctions et systèmes biologiques clés (la fonction cardiaque, le système immunitaire).
Exemples :
- Caractérisations fonctionnelle et ultrastructurale des mécanismes du Couplage Excitation-Contraction (CEC) de la fonction cardiaque.
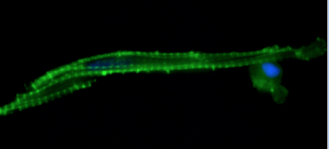
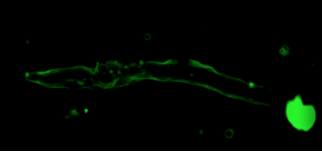
- Mise au point de marquages/immunomarquages pour l’observation de structures intracellulaires de divers modèles biologiques (poissons (figures 2 et 3), bivalves).
- Analyses iso/ratiométriques de cellules cardiaques chez le poisson (sole, bar, mulet, killifish) permettant ainsi de mesurer les flux et la concentration calciques intracellulaires.
|
|
|---|
- Suivi de différentes activités intracellulaires (ex : viabilité, apoptose, activité enzymatique estérase, stress oxydant) suite à des modifications environnementales (polluants, température) sur cardiomyocytes de poissons, hémocytes de bivalves, ou gamètes d’oursins.
- Par sa position en contact étroit avec le milieu environnant, l’épithélium branchial des poissons téléostéens constitue l’une des principales voies d’entrée des contaminants aquatiques. Dans ce cadre nous nous intéressons aux répercussions de ces contaminations sur la communication jonctionnelle d’une lignée cellulaire de branchie de truite arc-en-ciel.
Projets en lien avec d’autres équipes du laboratoire :
- Etude des biofilms marins : en environnement marin, ces biofilms microbiens recouvrent la plupart des surfaces solides. La formation de ces biofilms a particulièrement attiré l’attention des chercheurs de LIENSs ces dernières années, . Les structures de ces biofilms marins sont analysées à l’aide de la microscopie (Figure 4). Projet en lien avec les équipes BIOFEEL/BCBS du laboratoire.

- Mise au point de technique d’hybridation moléculaire dite CARD-FISH (CAtalysed Reported Deposition-Fluorescence In Situ Hydridization) permettant de quantifier la part de Bactéries et d’Archées au sein des communautés de procaryotes benthiques (vasière de Marennes-Oléron, Charente-Maritime). Projet en lien avec l’équipe BIOFEEL du laboratoire.
Équipements principaux
![]()
![]() Microscope inversé automatisé DMI 6000 B, Leica Microsystems CMS, équipé d’un boitier oligochrome TILL Photonics GmbH avec jeu de filtres à fluorescence. (financements obtenus dans le cadre du Contrat de Projet Etat-Région 2007-2013, et d’un projet FEDER Poitou-Charentes)
Microscope inversé automatisé DMI 6000 B, Leica Microsystems CMS, équipé d’un boitier oligochrome TILL Photonics GmbH avec jeu de filtres à fluorescence. (financements obtenus dans le cadre du Contrat de Projet Etat-Région 2007-2013, et d’un projet FEDER Poitou-Charentes)
Responsable : Nathalie Imbert – +33 (0)5 46 50 76 32 – nimbert@univ-lr.fr
![]() Spectrofluorimètre SAFAS Xenius XM pour microplaques. Responsable Hélène Thomas-Guyon – +33 (0)5 46 50 76 23 – hthomas@univ-lr.fr
Spectrofluorimètre SAFAS Xenius XM pour microplaques. Responsable Hélène Thomas-Guyon – +33 (0)5 46 50 76 23 – hthomas@univ-lr.fr
Équipements associés
![]() Platine thermostatée
Platine thermostatée
![]() Osmomètre cryoscopique
Osmomètre cryoscopique
![]() Cytocentrifugeuse
Cytocentrifugeuse
![]() Système de mesure de la contraction sur organe isolé
Système de mesure de la contraction sur organe isolé