Poupard Nicolas

- Équipe de rattachement : BCBS
- nicolas.poupard@univ-lr.fr
Thèse de doctorat 2014/2017
Ecole doctorale Gay-Lussac
Formation d’origine :
Master Recherche SOB (Synthèse Organique et Biocatalyse), 2012/2013
(2014-2017) Conception de vecteurs moléculaires intelligents pour la thérapeutique des tumeurs
Mots clés : héparanase, cathepsine D, vectorisation, pro-drogues, théranostique
Directeur de thèse :
Thierry MAUGARD, Professeur des Universités, Université de La Rochelle, LIENSs UMR 7266
Ingrid ARNAUDIN-FRUITIER, Maître de conférence HDR, Université de La Rochelle, LIENSs UMR 7266
Responsables scientifiques :
Jean-Marie PIOT, Professeur des universités, Université de La Rochelle, CNRS, LIENSs UMR 7266
Nicolas BRIDIAU, Maître de Conférences, Université de La Rochelle, CNRS, LIENSs UMR 7266
Financement : Association Ligue contre le Cancer
Conception de vecteurs moléculaires intelligents pour la thérapeutique des tumeurs
En effet, ces microenvironnements sont caractérisés par la surexpression de certaines protéases, notamment la cathepsine D mais également l’héparanase, une glycosyl-hydrolase, qui dans des conditions physiopathologiques favorisent le développement des métastases et la néovascularisation des tumeurs. Le nano-outil se doit d’être actif uniquement en milieu tumoral pour une vectorisation efficace. Il comporte un glycopeptide regroupant une partie peptidique dont la séquence est reconnue et hydrolysée par la cathepsine D et une partie glycosidique sulfatée inhibitrice de l’héparanase. Une fois reconnu par la cathepsine D, le peptide est hydrolysé, c’est la fonction "activation" du vecteur. Le polysaccharide sulfaté est alors relargué et peut exercer son activité inhibitrice de l’héparanase, c’est la fonction "traitement" du vecteur.
La conception du nano-outil peut être envisagée selon deux voies différentes, l’une menant à une fonction diagnostique avec l’utilisation d’un Fluorochrome et l’autre visant l’utilisation d’un polysaccharide inhibiteur de l’héparanase à des fins thérapeutiques. (Figure 1)
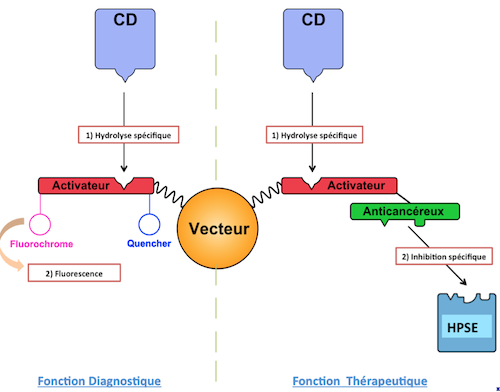
- Figure 1 : mécanismes d’action dans le microenvironnement tumoral du nanosystème envisagé de deux manières .
- CD : Cathepsin D ; HPSE : Héparanase
Ces travaux s’inscrivent dans la continuité de ceux effectués par M. Oussama Achour lors de sa période de doctorat (2011/2014). En effet, les travaux effectués sur ce projet ont notamment permis l’obtention d’une séquence peptidique reconnue par la cathepsine D extracellulaire, ainsi que la mise au point d’un test mesurant l’activité héparanase .
L’objectif de cette thèse est maintenant de synthétiser et d’optimiser la partie glycopeptidique du nano-outil de manière à ce qu’elle soit effective en milieu tumoral pour l’inhibition de l’héparanase.
Dans un premier temps, il conviendra donc de compléter les travaux antérieurs et de tester l’inhibition de l’héparanase par de nouveaux oligosaccharides sulfatés ou ayant subis des étapes de dépolymérisation et/ou des modifications physicochimiques.
Dans un second temps, une étude sera réalisée quant à la création d’une liaison glycopeptidique entre les oligosaccharides d’intérêt et le peptide reconnu par la cathepsine D extracellulaire développé par M. Achour. Cette étape est envisagée par formation d’une liaison oxime entre un résidu Lysine modifié du peptide et l’extrémité réductrice des oligosaccharides sulfatés. Une étude structure/réactivité entre le glycopeptide nouvellement formé et la cathepsine D extracellulaire ainsi qu’une étude cinétique de l’inhibition de l’héparanase par le fragment polysaccharidique issu de l’hydrolyse du glycopeptide devront s’en suivre.
Ces études seront effectuées aussi bien avec des enzymes commerciales pures qu’avec des cellules de lignées tumorales immortalisées qui surexpriment les deux enzymes.
Le glycopeptide sera par la suite fourni à nos collaborateurs qui le lieront à une nano-vecteur (encore indéterminé).
Une dernière étude structure/réactivité vis-à-vis de la cathepsine D et une étude cinétique de l’inhibition de l’héparanase s’imposeront sur le nano-outils entier
Principales collaborations :
- IRCM (Université de Montpellier 1)
- CBM (UPR CNRS 4301, Orléans)
- IC2MP (Université de Poitiers)
- LCSN (Université de Limoges)
Liste des publications :
* Cette liste est une extraction automatique des publications référencées sous HAL qui est susceptible de contenir des doublons. Ces derniers sont en cours d’analyse et seront supprimés prochainement.



