Manseur Chanez

- Équipe de rattachement : BCBS
- Statut : Chercheur contractuel
- chanez.manseur*at*univ-lr.fr, chanez.manseur*at*etudiant.univ-lr.fr
Thèse de doctorat (2020-2023)
Ecole doctorale de l’Université de La Rochelle
Formation d’origine :
Master Biotechnologies parcours Protéomique, Université de Lille, 2019-2020
(2020-2023) Conception et optimisation d’oligosaccharides marins sulfatés pharmacomodulateurs de la progression tumorale
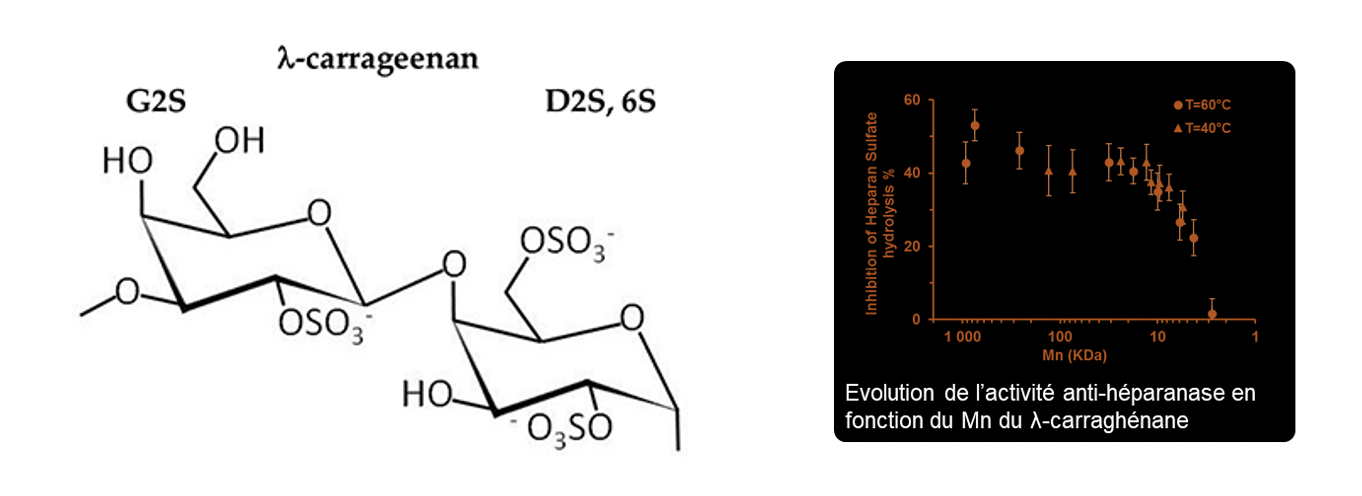
Mots clés : Lamda-carraghénane, purification par chromatographie, caractérisation structurale, cancer, prolifération, invasion, angiogenèse…
Responsables scientifiques :
– Ingrid Fruitier Arnaudin, Maître de Conférences, La Rochelle Université, LIENSs UMR 7266.
– Thierry Maugard, Professeur des Universités, La Rochelle Université, LIENSs UMR 7266.
– Hugo Groult, Chercheur CRCN CNRS, LIENSs UMR 7266.
Financement : Bourse de thèse de l’Université de la Rochelle
Conception et optimisation d’oligosaccharides marins sulfatés pharmacomodulateurs de la progression tumorale
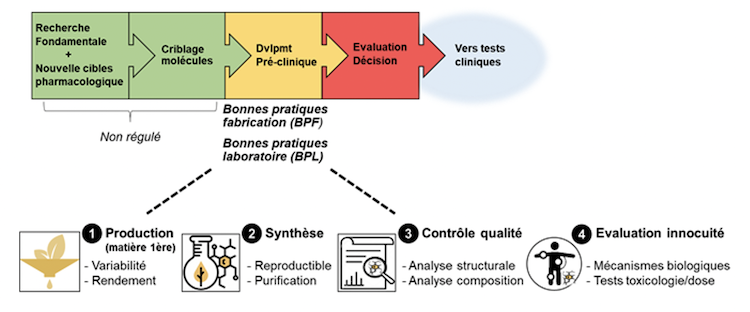
L’utilisation de PS de manière générale nécessite des procédures de purification et de caractérisation structurale afin de valider leurs activités biologiques Le premier objectif du projet est l’obtention d’un produit de seconde génération avec un degré de pureté le plus haut possible en utilisant des techniques chromatographiques telle que la gel filtration. La purification sera suivie de l’élucidation structurale par spectrométrie de masse. Le second objectif consiste à tester in vitro et in vivo les activités biologiques (effets anti-prolifératif, anti-angiogénique, anti-invasif…etc) du produit purifié caractérisé (Fig.2).
Principales collaborations :
- Géraldine Siegfried, INSERM U1029, Bordeaux. Groupe : Preprotéine converstases, invasion tumorale et métastases.
- Nivet, Emmanuel, UMR 7051 CNRS-Aix-Marseille Université.
- Catherine Grillon, CBM UPR CNRS 4301, Orléans. Groupe : Microenvironnement cellulaire et pharmacologie des récepteurs.
- Angela Sutton, LVTS-SMBH-INSERM U1148, Paris. Groupe : Biothérapies et Glycoconjugués
- Frank Morel, LITEC EA 4331, Poitiers. Groupe : Inflammation, Tissus Epithéliaux et Cytokines.
Publications représentatives de l’activité de recherche :
[1] H. Groult, R. Cousin, C. Chot-Plassot, M. Maura, N. Bridiau, J.-M. Piot, T. Maugard, I. Fruitier-Arnaudin, λ-Carrageenan Oligosaccharides of Distinct Anti-Heparanase and Anticoagulant Activities Inhibit MDAMB-231 Breast Cancer Cell Migration, Marine Drugs 17 (2019) 140. 10.3390/md17030140.
[2] N. Poupard, H. Groult, J. Bodin, N. Bridiau, S. Bordenave-Juchereau, F. Sannier, J.M. Piot, I. FruitierArnaudin, T. Maugard, Production of heparin and lambda-carrageenan anti-heparanase derivatives using a combination of physicochemical depolymerization and glycol splitting, Carbohydr Polym 166 (2017) 156-165. 10.1016/j.carbpol.2017.02.040.
[3] N. Poupard, P. Badarou, F. Fasani, H. Groult, N. Bridiau, F. Sannier, S. Bordenave-Juchereau, C. Kieda, J.M. Piot, C. Grillon, I. Fruitier-Arnaudin, T. Maugard, Assessment of Heparanase-Mediated Angiogenesis Using Microvascular Endothelial Cells : Identification of lambda-Carrageenan Derivative as a Potent Anti Angiogenic Agent, Mar Drugs 15 (2017). 10.3390/md15050134.
[4] H. Groult, N. Poupard, F. Herranz, E. Conforto, N. Bridiau, F. Sannier, S. Bordenave, J.M. Piot, J. RuizCabello, I. Fruitier-Arnaudin, T. Maugard, Family of Bioactive Heparin-Coated Iron Oxide Nanoparticles with Positive Contrast in Magnetic Resonance Imaging for Specific Biomedical Applications, Biomacromolecules 18 (2017) 3156-3167. 10.1021/acs.biomac.7b00797.
[5] O. Achour, N. Poupard, N. Bridiau, S. Bordenave Juchereau, F. Sannier, J.M. Piot, I. Fruitier Arnaudin, T. Maugard, Anti-heparanase activity of ultra-low-molecular-weight heparin produced by physicochemical depolymerization, Carbohydrate Polymers 135 (2016) 316-323. 10.1016/j.carbpol.2015.08.041.
Activités d’enseignement :
- Monitorat à l’Université de La Rochelle au sein du département de Biotechnologies
- Coordination de l’atelier projet de vulgarisation scientifique réalisé dans le cadre des formations du CIES Centre : La pluridisciplinarité de la recherche au service de l’environnement.